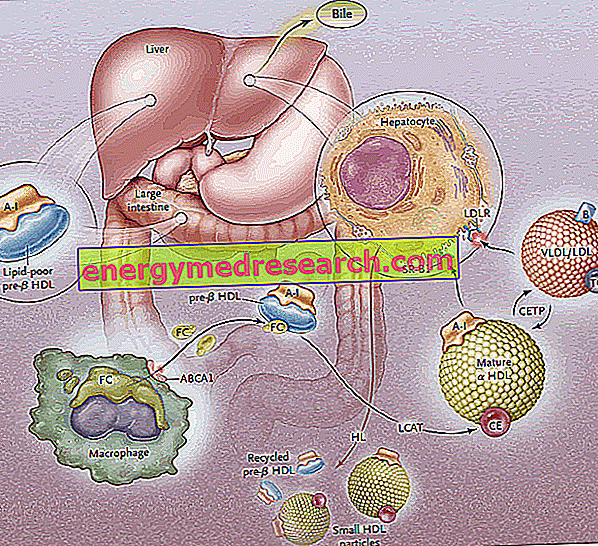
Le transport inverse du cholestérol (RCT) est le processus par lequel le cholestérol est éliminé des tissus périphériques, par son incorporation dans les lipoprotéines HDL et son transport ultérieur vers le foie pour l'excrétion biliaire.
Les cellules périphériques, comme toutes les cellules non intestinales ou hépatiques, ne sont pas en mesure de dégrader l'excès de cholestérol; par conséquent, pour le maintien de l'homéostasie cellulaire, la présence d'un mécanisme dédié à l'élimination du cholestérol des cellules est essentielle. Ce mécanisme, destiné à la récupération hépatique de l'excès de cholestérol périphérique, est appelé "transport inverse du cholestérol" (ECR: transport inverse du cholestérol ).
Examinons le processus en détail.
La biosynthèse des lipoprotéines HDL passe par la synthèse et la sécrétion initiale des composants protéiques principaux (apoprotéines), puis par l'acquisition extracellulaire des lipides (phospholipides et cholestérol), ce qui conduit à l'assemblage et à la génération de particules HDL matures.
La première étape du transport inverse du cholestérol consiste en la production, par l’intestin et le foie, de précurseurs discoïdes de HDL, qui exposent à leur surface les apoprotéines (principalement ApoA-I); ainsi, des précurseurs de HDL appelés pré-B-HDL sont libérés, qui incorporent de très petites quantités de cholestérol et de lipides, en particulier de phospholipides. La présence de ces molécules précurseurs au niveau périphérique favorise le transfert de l'excès de cholestérol (FC) libre - fuite des cellules des tissus périphériques - vers l'apo AI, par l'intervention d'un transporteur à membrane appelé cassette de liaison à l'ATP A1 (ABCA1). ). Ce transporteur est situé à la surface de la cellule et dans les membranes de Golgi et peut transporter les lipides de l'appareil de Golgi à la membrane cellulaire, facilitant ainsi leur efflux. À ce stade, dès que le cholestérol libre pénètre dans les HDL natifs, une enzyme plasmatique d’origine hépatique intervient, appelée lécitine-cholestérol acyltransférase plasmatique ou plus simplement LCAT; cette enzyme convertit le cholestérol libre incorporé dans les pré-B-HDL en esters de cholestérol, transformant les pré-B-HDL en une forme mature d'α-HDL; en pratique, l'accumulation continue de cholestérol dans le noyau de la lipoprotéine transforme le HDL discoïde en particules sphériques et charnues, qui peuvent ensuite acquérir des apoprotéines à partir des particules de lipoprotéines riches en triglycérides et se mélanger. Dans l'ensemble du processus, l'apolipoprotéine AI joue un rôle clé en stimulant à la fois l'activité du transporteur ABCA1 et celle de la LCAT. ApoAI étant l’apolipoprotéine la plus largement représentée dans les HDL, sa concentration plasmatique est directement liée aux taux de cholestérol HDL.
REMARQUE: le processus d'estérification est essentiel pour empêcher la rediffusion du cholestérol des HDL vers la membrane plasmique; ce mécanisme exploite l'acide gras en position deux présent dans les molécules de phosphatidylcholine.
Le processus d'estérification à médiation par LCAT transforme ensuite les molécules pré-B-HDL en leur forme sphérique "mature" a-HDL. Ces lipoprotéines sont ensuite transportées vers le foie, où elles libèrent du cholestérol, selon deux voies distinctes.
Dans le premier cas, les HDL riches en cholestérol estérifié cèdent ce lipide à des lipoprotéines riches en triglycérides (lipoprotéines de très basse et basse densité), puis interceptées par le foie par des récepteurs spécifiques (LDL-R) et retirées de la circulation. L’objectif est de canaliser le cholestérol périphérique vers le foie par le système récepteur LDL, en "téléchargeant" ainsi le HDL de l’excès de cholestérol vers le niveau périphérique, afin de le rendre à nouveau disponible pour le recevoir des tissus; vides de cholestérol, les HDL acceptent les triglycérides en échange, grâce à la protéine de transfert d’esters de cholestérol (CETP). La tâche de cette protéine est donc de promouvoir la redistribution et l’équilibre des esters de cholestérol et de triglycérides parmi les HDL, LDL, IDL, VLDL, les chylomicrons et les chnomicrons restants, aboutissant ainsi à un enrichissement en les triglycérides des HDL, au détriment des esters de cholestérol, et une réduction de la taille des HDL.
La deuxième voie implique des récepteurs du foie SR-B1 pour les HDL riches en cholestérol estérifié, en l'absence de dégradation concomitante de la partie protéique des HDL, qui est ensuite recyclée. En pratique, cette enzyme vous permet de vider les HDL de leur contenu et de régénérer de nouvelles pré-B-HDL. Une partie des HDL et de l'ApoA-I est toutefois intériorisée et dégradée au niveau lysosomal, aussi bien dans les cellules hépatiques que rénales. L'absorption médiée par SR-B1 est rendue plus efficace par l'activité de la lipase hépatique, capable de remodeler le HDL en hydrolysant les phospholipides de surface et en permettant le flux de cholestérol estérifié par le noyau de la lipoprotéine vers la membrane plasmique (l'hypothèse est la suivante). D'autre part, l'ApoE est également impliqué dans l'absorption sélective, car les souris déficientes pour le gène ApoE présentent une réduction de l'efficacité de cette voie). Le SR-BI s'exprime principalement dans le foie, les surrénales et les ovaires.