généralité
Le myélome multiple est une tumeur maligne qui affecte certaines cellules du système immunitaire et endommage divers organes et tissus. Il se développe généralement chez les personnes de plus de 50 ans et s'accompagne souvent de douleur, de fractures et de destruction des os.
Le myélome multiple est diagnostiqué avec des tests sanguins et médullaires, une électrophorèse de protéines dans les urines et des examens radiologiques. La rémission des maladies peut être induite par des stéroïdes, une chimiothérapie, des inhibiteurs du protéasome, des médicaments immunomodulateurs (tels que la thalidomide ou le lénalidomide) et une greffe de cellules souches.
Causes
Les causes du myélome multiple sont en partie inconnues. Il ressort des statistiques médicales que l’incidence augmente chez les sujets exposés aux rayonnements ionisants ou à certaines substances chimiques (dérivés du pétrole et autres hydrocarbures, solvants, pesticides, amiante, etc.). Des facteurs génétiques familiers, une stimulation antigénique répétée et des agents viraux peuvent également participer à l'étiologie du myélome multiple.
Les symptômes
Pour approfondir: les symptômes du myélome multiple
Le myélome multiple survient principalement à la fin de l’âge (plus de 50 ans). Les signes et les symptômes peuvent varier considérablement d'une personne à l'autre, car de nombreux organes peuvent être impliqués dans la maladie. Au début, la condition peut ne causer aucun symptôme. Au fur et à mesure de l'évolution de la maladie, des symptômes liés à l'infiltration d'organes plasmacellulaires et à la production excessive d'immunoglobulines monoclonales sont susceptibles de se produire:
- Douleurs osseuses. Les douleurs osseuses touchent près de 70% des patients atteints de myélome multiple et constituent le symptôme le plus courant. Il est principalement situé au niveau de la colonne vertébrale, du bassin, des côtes, des os longs et du crâne. La symptomatologie initiale est "pseudoreumatica", alors qu'une douleur localisée aiguë et persistante pourrait indiquer une fracture osseuse pathologique. L'implication des vertèbres peut entraîner une compression de la moelle épinière. Dans le myélome multiple, les lésions osseuses sont secondaires à l'apparition de lésions "lytiques" et à l'ostéopénie liée à la prolifération de plasmocytes myélomateux dans la cavité médullaire. En fait, les cellules du myélome multiple produisent divers facteurs (regroupés dans la dénomination OAF, Facteur activant les ostéoclastes) qui permettent aux ostéoclastes d’accélérer la démolition du tissu osseux, par réabsorption. Les ostéoblastes ("producteurs d'os") ne subissant pas le même stimulus prolifératif, la masse osseuse diminue progressivement. Cela modifie la structure du tissu, rendant les os fragiles et sujets aux fractures, à l'ostéoporose et aux écrasements (vertèbres). Du point de vue radiologique, le réarrangement osseux est évident pour l'apparition de points "perforés", qui coïncident avec les zones dans lesquelles l'ostéocondensation est absente. L'augmentation des lésions osseuses peut également augmenter la libération de calcium dans le sang (hypercalcémie).
- L'hypercalcémie . Un taux élevé de calcium dans le sang affecte le fonctionnement des nerfs et provoque une soif excessive, des nausées, une constipation, une perte d'appétit et une confusion mentale. L'hypercalcémie est due à l'infiltration de cellules malignes dans les os.
- Insuffisance rénale. Plusieurs facteurs interviennent dans le conditionnement de la fonction rénale. Des taux élevés d'immunoglobulines? <Monoclonaux anormaux (protéines? <M), peuvent provoquer des lésions tubulaires en raison de leur dépôt dans les glomérules (protéinurie de Bence Jones). Une résorption osseuse accrue conduit à une hypercalcémie et à une néphrocalcinose, contribuant ainsi à l'insuffisance rénale. Les autres causes incluent la néphropathie hyperuricémique (due au dépôt d'acide urique), l'infiltration locale de cellules tumorales, les infections récurrentes (pyélonéphrite) et l'amyloïdose.
- L' anémie. Dans le myélome multiple, la déficience en globules rouges provient de l’absence de production de globules "sains" au profit de clones tumoraux dans la moelle osseuse. L'anémie peut entraîner une asthénie, une faiblesse générale et des difficultés respiratoires.
L'acronyme CRAB fait souvent référence à ces quatre problèmes, communs aux niveaux de calcium, d'insuffisance rénale, d'anémie et de lésion osseuse → C = Calcium (élevé), R = Insuffisance rénale, A = Anémie, B = lésions osseuses
Les autres signes et symptômes du myélome multiple peuvent inclure:
- Infections : la réduction des globules blancs (leucopénie) conduit à un déficit immunitaire, donc à une moindre résistance aux infections. Celles-ci peuvent être de gravité clinique différente (pneumonie, sinusite, infections de la peau, de la vessie ou des reins) et représentent la principale cause de décès des patients atteints de myélome multiple. La période de risque d'infections la plus grande inclut les premiers mois après le début de la chimiothérapie.
- Troubles de l’hémostase : une insuffisance plaquettaire (thrombocytopénie) entraîne des modifications du processus de coagulation, qui se manifeste par une tendance marquée à saigner. Globalement, la demi-vie plaquettaire est réduite et l'interaction avec l'endothélium vasculaire est altérée. D'autres anomalies de l'hémostase résultent d'une fibrinolyse réduite.
- Syndrome d'hyperviscosité : dans certains cas de myélome multiple, on observe une augmentation de la viscosité plasmatique, entraînant des symptômes hémorragiques, des troubles neurologiques et une ischémie coronaire.
- Troubles neurologiques : les manifestations neurologiques associées au myélome multiple sont hétérogènes. L'apparition de douleurs névritiques et d'une faiblesse ou d'un engourdissement des membres sont les symptômes les plus courants. Enfin, il peut exister une douleur racinaire et une compression de la moelle épinière dues à une atteinte vertébrale, un syndrome du canal carpien et d'autres neuropathies causées par l'infiltration de dépôts amyloïdes au niveau du nerf périphérique.
diagnostic
Le médecin peut détecter les signes de myélome multiple au moyen d'analyses de sang et d'urine effectuées au cours d'un examen physique de routine. Si le patient est asymptomatique, ces tests de laboratoire peuvent être répétés régulièrement afin de suivre l'évolution de la maladie et de déterminer le meilleur moment pour commencer le traitement. La participation d'organes est un critère de diagnostic important pour le myélome multiple.
Examens de laboratoire
Dans de nombreux cas, le test hémochromocytométrique établit la présence d’une anémie (Hb <10 g / dl). Le frottis sanguin périphérique permet de détecter des rouleaux de globules rouges empilés (conséquence d'une augmentation de la viscosité plasmatique). La neutropénie et la thrombocytopénie coexistent souvent, ce qui s'aggrave au stade terminal de la maladie.
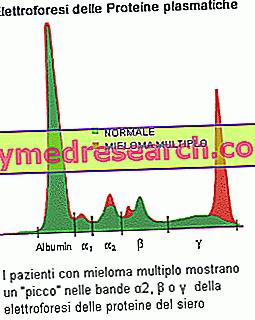
L' électrophorèse des protéines sériques permet de mettre en évidence la présence de paraprotéines produites par le clone tumoral: la suspicion de myélome est fondée si la bande (pic) est pertinente dans le profil électrophorétique, avec un composant M> 30 g / L. Une autre constatation courante est la protéinurie de Bence Jones, caractérisée par la présence dans l’urine de paraprotéines constituées de chaînes légères de type monoclonal. Les mesures quantitatives de la composante M sont nécessaires pour établir un diagnostic de myélome multiple et surveiller la maladie. Des tests sanguins établissent une augmentation du taux de sédimentation érythrocytaire (ESR) et déterminent les modifications du taux de calcium (élevé chez les personnes atteintes d'un myélome multiple avancé), d'albumine (de faibles taux corrélés avec le myélome avancé), d'acide urique (uricémie) et de en raison d'une fonction rénale réduite). Le médecin peut également effectuer d'autres tests pour vérifier la présence de bêta-2-microglobuline, une autre protéine produite par les plasmocytes myélomateux. Cela peut être un indicateur utile dans la stadification du patient: des niveaux élevés indiquent une maladie plus avancée et un pronostic plus sombre.
Techniques d'imagerie
L'enquête radiologique montre l'implication du squelette. L'imagerie par résonance magnétique est plus sensible que la radiographie standard dans la détection des lésions lytiques et peut prédéfinir la présence de réarrangements osseux.
Examen de la moelle osseuse
L’examen de la moelle osseuse met en évidence un certain nombre de cellules plasmatiques: pour que le myélome multiple soit défini comme un diagnostic, le nombre de clones tumoraux doit être supérieur à 10%. Une partie de l'échantillon est également testée pour évaluer la présence d'altérations caractéristiques du caryotype, soit par cytogénétique classique, soit par l'utilisation de techniques d'hybridation fluorescente in situ (FISH). Les anomalies chromosomiques les plus fréquemment observées dans le myélome multiple concernent les chromosomes 1, 3, 5, 11, 13 et 14. En particulier, la monosomie du chromosome 13 est corrélée à une survie réduite, associée à un taux élevé de prolifération et de résistance aux médicaments.
Stadification et pronostic
Les examens diagnostiques peuvent confirmer le tableau clinique du myélome multiple. De plus, les résultats de ces tests permettent au médecin de classer la maladie dans les stades 1, 2 ou 3. Les personnes atteintes de myélome au stade 3 présentent un ou plusieurs signes de maladie avancée, notamment un plus grand nombre de clones de tumeurs et une insuffisance rénale. En outre, le résultat de la biopsie de la moelle osseuse permet au médecin de déterminer le profil de risque global du patient et de développer le meilleur plan thérapeutique.
| Stadification du myélome multiple (selon Durie-Salmon) | ||
| Stade clinique | paramètres | Masse tumorale (nombre de cellules) |
| Étape 1 | Tout ce qui suit:
| <0.5x1012 / m2 |
| Stade 2 | Aucun des critères des phases I et III | 0, 5-1, 2x1012 / m2 |
| Étape 3 | Un ou plusieurs des éléments suivants:
| > 1, 2x1012 / m2 |
Les étapes 1, 2 et 3 du système d'évaluation de Durie-Salmon peuvent être subdivisées en A ou B, en fonction de la créatinine sérique:
- A: créatinine <2 mg / dl (<177 mmol / L)
- B: créatinine sérique> 2 mg / dl (> 177 micromol / L)
Récemment, un autre système de transfert appelé système international de stockage multiple a été proposé.
Indice pronostique international sur le myélome (publié par l'International Staging System - 2005) | ||
stade | critères | Survie moyenne (mois) |
la |
| 62 |
II | h42-microglobuline <3, 5 mg / L et albumine <3, 5 g / dl ou β2-microglobuline 3, 5-5, 5 mg / L indépendamment de l'albumine sérique | 44 |
III | β2-microglobuline ≥ 5, 5 mg / L | 29 |
traitement
Pour plus d'informations: Médicaments contre le myélome multiple
Le traitement du myélome multiple est axé sur les thérapies réduisant la population clonale. Si la maladie est complètement asymptomatique, la gestion se limite à l'observation clinique. En présence de symptômes, le traitement peut aider à soulager la douleur, à contrôler les complications, à stabiliser l'état et à ralentir la progression de la tumeur.
Thérapie de première ligne
Ces dernières années, la chimiothérapie à haute dose avec greffe de cellules souches hématopoïétiques autologues (autotransplantation) est devenue l’option de traitement la plus appropriée pour les patients de moins de 65 ans. Avant l'autotransplantation, un cycle initial de chimiothérapies d'induction est en mesure de réduire la masse néoplasique. Les schémas thérapeutiques les plus couramment utilisés impliquent l'administration de thalidomide (+ dexaméthasone), de bortézomib et de lénalidomide (+ dexaméthasone). Un traitement avec de fortes doses de chimiothérapie et un support de cellules souches (autotransplantation) n'est pas curatif, mais peut prolonger la survie globale et entraîner une rémission complète. La greffe allogénique de cellules souches, c’est-à-dire d’une personne en bonne santé au patient affecté, représente un traitement potentiel, mais elle n’est disponible que pour un faible pourcentage des cas cliniques. Les patients âgés de plus de 65 ans et présentant une maladie concomitante importante ne tolèrent souvent pas la greffe de cellules souches. Pour ces personnes, le traitement standard consiste souvent en une chimiothérapie au melphalan (pendant 4 à 7 jours) associée à la prednisone (5 à 10 jours), par cycles répétés toutes les 6 semaines, suivies d'une période de repos. Chez certains patients, l'association de ce protocole à de nouveaux schémas thérapeutiques, comprenant par exemple l'administration de bortézomib, peut être utile. Ce médicament est un inhibiteur du protéasome (complexe de plusieurs protéines présent dans toutes les cellules), qui permet d’obtenir des réponses cliniques complètes chez les patients présentant une maladie réfractaire ou à évolution rapide. Le mécanisme d'action du bortézomib repose sur l'induction de l'apoptose dans les cellules tumorales, bloquant l'action des protéasomes. Une réponse clinique significative est retrouvée dans environ 50% des cas
Thérapie de soutien
En plus du traitement direct du myélome multiple, des bisphosphonates (pamidronate ou acide zolédronique, par exemple) sont systématiquement administrés pour contrôler les lésions lytiques et prévenir les fractures osseuses. Les transfusions à base de globules rouges et d'érythropoïétine sont utiles pour la correction des symptômes associés à l'anémie, alors que l'administration de concentrés plaquettaires peut prévenir les saignements causés par la thrombocytopénie. Les stéroïdes et les bisphosphonates jouent également un rôle important dans le traitement des crises hypercalcémiques, tandis que les antibiotiques facilitent la gestion des infections.



