morphologie
Au niveau macroscopique, on peut observer dans la maladie d'Alzheimer un degré d'atrophie (réduction de la masse des tissus ou des organes) corticale, caractérisé par un élargissement des sillons pariétaux, plus accentué dans les lobes frontaux, temporaux et pariétaux. Cette atrophie est compensée par un élargissement des cavités ventriculaires consécutif à la perte de parenchyme (Figure 1). En particulier, dans les stades avancés de la maladie, les structures du lobe temporal médian, y compris l'hippocampe, le cortex entorhinal et l'amygdale, présentent une atrophie sévère, du fait de leur implication dès les premiers stades de la maladie.
En outre, la maladie d'Alzheimer présente également des altérations microscopiques, appelées plaques séniles extracellulaires et amas neurofibrillaires intracellulaires, qui constituent la base du diagnostic histologique. Avec la progression de la maladie, il se produit alors une grave perte neuronale accompagnée de gliose (prolifération circonscrite ou diffuse, de nature réactive, de cellules de la neurolyse, c'est-à-dire des cellules qui constituent le stroma support du tissu nerveux), dans les mêmes régions. où la présence de plaques neurofibrillaires et d'amas est plus importante.
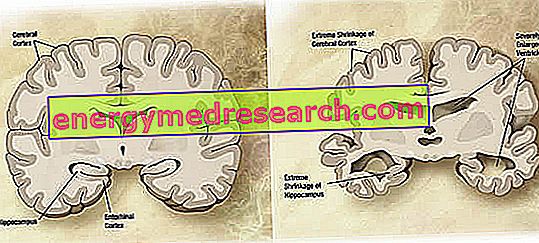
Figure 1. Coupe coronale du cerveau: différences entre le cerveau normal et le cerveau affecté par la maladie d'Alzheimer (source d'images wikipedia).
pathogénèse
La maladie d'Alzheimer se caractérise principalement par deux lésions typiques: l'accumulation extracellulaire de plaques séniles constituées principalement du peptide β-amyloïde (Aβ) et des amas neurofibrillaires intraneuronaux, formés par la protéine tau hyperphosphorylée.
- Les plaques séniles se retrouvent au niveau des zones cérébrales telles que l'hippocampe, l'amygdale et le néocortex.
Le peptide Aβ provient d'une coupe protéolytique du précurseur de la protéine amyloïde (APP) par la β-sécrétase. Cette coupe génère un fragment carboxy terminal de 99 résidus (CTF ou C99) qui est ensuite coupé par la β-sécrétase pour générer des fragments Aβ de différentes longueurs. On sait que l'espèce de Aβ la plus abondante est constituée par le fragment Aβ40. Un autre fragment connu qui se forme à partir de la coupe protéolytique, moins abondant que l'Aβ40, est l'Aβ42, plus susceptible de former des fibrilles amyloïdes, qui s'accumulent sous forme d'espèce Aβ dans le cerveau d'un individu atteint de la maladie d'Alzheimer.
- Un autre composant présent dans la maladie d'Alzheimer est constitué d'agrégats neurofibrillaires constitués de faisceaux de filaments présents dans le cytoplasme des neurones. Les amas neurofibrillaires sont insolubles et semblent résister aux processus de protéolyse in vivo, restant ainsi présents dans les coupes de tissu longtemps après la mort neuronale. En observant la structure, les masses fibrillaires sont constituées de filaments à double brin et de filaments linéaires de composition similaire. En analysant la composition, les filaments double brin sont davantage composés de protéine tau hyperphosphorylée. Le tau est une protéine axonale, associée à des microtubules facilitant son assemblage.
Parmi les autres changements neuropathologiques importants dans la maladie d'Alzheimer, on peut citer le dysfonctionnement mitochondrial, les dommages neuronaux oxydatifs, la perte synaptique et la dégénérescence axonale.
Aspects neurochimiques
Comme cela a déjà été expliqué, le peptide Aβ, issu de la coupure protéolytique du précurseur de l'APP, représente un composant neurotoxique de la maladie d'Alzheimer . Plus précisément, on a émis l'hypothèse que l'Aβ pourrait être important pour les fonctions cérébrales normales et, s'il dépasse certaines concentrations, il peut devenir neurotoxique. De plus, les agrégats et les différentes isoformes de Aβ peuvent avoir un rôle biologique, physiologique ou pathologique différent, déterminant et participant aux stades avancés de la maladie. En fait, il a été observé que l'Aβ agit comme un neuromodulateur et affecte la libération de certains neurotransmetteurs en l'absence de signes évidents de neurotoxicité.
Par exemple, le rôle neuromodulateur de l'Aβ, dans un contexte physiologique, pourrait avoir une importance majeure pour le bon équilibre du système de neurotransmetteurs. En fait, il est connu que ce système est constitué de neurotransmetteurs, substances qui transmettent des informations entre les cellules constituant le système nerveux, les neurones, par le biais de la transmission synaptique.
Dans les conditions pathologiques, la transmission synaptique médiée par l'Aβ pourrait plutôt être liée à une altération de la neurotransmission avant les événements neurodégénératifs. En raison de ces changements, des troubles cognitifs et non cognitifs précoces peuvent survenir, en fonction des systèmes de neurotransmetteurs affectés et des différentes régions du cerveau impliquées.
Les altérations des systèmes de neurotransmetteurs et du mécanisme de transduction du signal dans le cerveau des personnes atteintes de la maladie d'Alzheimer sont très complexes. L'un des systèmes modifiés concerne le système de signalisation cholinergique, qui implique le neurotransmetteur acétylcholine. En fait, il a été démontré que la transmission cholinergique au niveau du cortex et de l'hippocampe était réduite chez les personnes atteintes de la maladie d'Alzheimer, d'importantes régions du cerveau responsables de phénomènes tels que l'apprentissage et la mémoire. Outre ce système neurotransmetteur, des altérations ont également été observées dans la maladie d'Alzheimer au niveau du système sérotoninergique noradrénergique, ainsi que du glutamate et du GABA.



