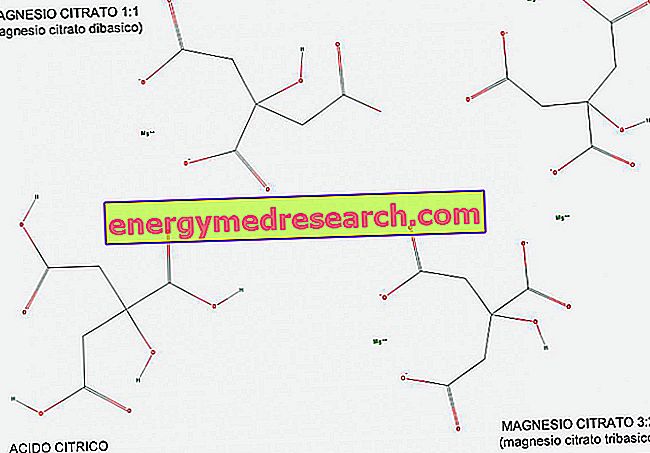
Un acide tribasique (ou triprotique) est un acide qui possède trois ions hydrogène à donner dans une réaction acide-base. Avec l'aide de la figure, nous pouvons voir comment l'acide citrique est un exemple d'acide tribasique, car il possède trois groupes carboxyliques COOH pouvant facilement donner de l'hydrogène H.
Le citrate de magnésium existe dans un rapport 1: 1 (1 molécule de magnésium par molécule de citrate) et dans une proportion de 3: 2 (3 molécules de magnésium pour 2 molécules de citrate).
Le citrate de magnésium 1: 1 est appelé dibasique car il s’agit d’un sel dibasique de l’acide citrique; en fait, il a 2 groupes basiques monovalents (COO-) par molécule, dérivés des 2 groupes carboxyliques qui ont cédé leur hydrogène au cours de la réaction.
Le magnésium 3: 2, quant à lui, est appelé tribasique car il contient 3 groupes basiques univalents (COO-) par molécule, dérivés des 3 groupes carboxyliques ayant abandonné leur hydrogène au cours de la réaction.
Le citrate de magnésium tribasique est nettement plus riche en magnésium (+ 42, 6% en poids) que le citrate de magnésium dibasique; de plus, il est plus alcalinisant, puisqu'il peut accepter trois ions hydrogène H + contre les deux acceptés par le dibasique. Cependant, il est moins soluble dans l'eau.