Qu'est-ce que Foscan?
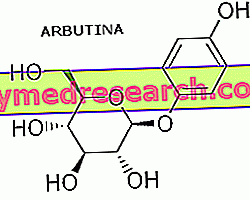
Foscan est une solution injectable contenant le principe actif témoporfine (1 ou 4 mg / ml).
À quoi sert Foscan?
Foscan est indiqué pour atténuer les symptômes du carcinome épidermoïde de la tête et du cou (un type de tumeur qui se développe à partir des cellules qui tapissent la bouche, le nez, la gorge ou l’oreille) à un stade avancé. Il est utilisé chez les patients pour lesquels d'autres traitements ne sont plus efficaces et ne conviennent pas à la radiothérapie (radiothérapie), à la chirurgie ou à la chimiothérapie systémique (médicaments utilisés dans le traitement du cancer; "systémique" signifie qu'ils agissent organisme entier).
Le médicament ne peut être obtenu que sur ordonnance.
Comment utiliser Foscan?
Foscan ne doit être administré que dans un centre de traitement du cancer, où une équipe peut évaluer le traitement du patient sous la supervision d'un médecin expérimenté en thérapie photodynamique (traitement qui exploite l'action de la lumière). Le traitement par Foscan est un processus en deux étapes: le médicament est d'abord administré puis activé à l'aide d'un laser. Le médicament est administré par une canule intraveineuse permanente (un mince tube inséré de façon permanente dans une veine) en une seule injection lente sur une période d'au moins six minutes. La dose est de 0, 15 mg par kilogramme de poids corporel. Quatre jours plus tard, toute la zone touchée par la tumeur doit être éclairée, jusqu'à 0, 5 cm au-delà de la marge environnante, avec une lumière générée par une source laser à une longueur d'onde spécifique pendant environ 3 minutes et 20 secondes. en utilisant un câble à fibre optique. Chaque zone du tissu tumoral doit être éclairée une seule fois par traitement. Pendant le traitement, les autres zones du corps doivent être protégées de la lumière, de sorte que le médicament ne soit activé que sur la tumeur. Si un deuxième cycle est requis, il doit être effectué avec un intervalle minimum de quatre semaines.
Comment fonctionne Foscan?
La substance active contenue dans Foscan, la témoporfine, est un agent photosensibilisant (une substance qui change lorsqu'elle est exposée à la lumière). Après l’injection de Foscan, la témoporfine est distribuée dans le corps, y compris dans la masse tumorale. Quand il est allumé avec une lumière laser à un
de longueur d'onde déterminée, la témoporfine est activée et réagit avec l'oxygène présent dans les cellules, créant un type d'oxygène hautement réactif et toxique. Il tue les cellules en réagissant avec leurs composants (protéines et ADN) et en les détruisant. En limitant l'éclairage à la tumeur, seules les cellules cancéreuses sont endommagées, sans affecter les autres parties du corps.
Quelles études ont été menées sur Foscan?
Foscan a fait l'objet de quatre études principales portant sur 409 patients atteints d'un carcinome de la tête ou du cou. Les trois premières études visaient à déterminer si la tumeur était éliminée après un maximum de trois cycles de traitement par Foscan sur un total de 189 patients. La quatrième étude portait sur la réduction des symptômes chez 220 patients atteints d'un cancer de la tête et du cou avancé, qui ne pouvaient pas subir de chirurgie ou de radiothérapie. Dans toutes les études, la réponse au traitement a été évaluée entre la 12ème et la 16ème semaine suivant le dernier cycle avec Foscan; Foscan n'a toutefois pas été comparé à d'autres médicaments.
Quel est le bénéfice démontré par Foscan au cours des études?
Les résultats des trois premières études n'étaient pas suffisants pour corroborer l'efficacité de Foscan dans l'éradication des carcinomes de la tête et du cou. Dans l'étude évaluant l'amélioration des symptômes chez les patients atteints d'un cancer avancé de la tête et du cou, 28 des 22 patients (22%) observés présentaient une amélioration significative des symptômes les plus gênants. Une réduction de la taille de la tumeur a également été observée chez environ le quart des patients participant à cette étude.
Quel est le risque associé à l'utilisation de Foscan?
Les effets indésirables les plus couramment observés sous Foscan (chez plus d'un patient sur 10) ont été les suivants: douleur au site d'injection, au niveau de la tumeur ou du visage, hémorragie, cicatrisation, nécrose de la bouche (mort cellulaire ou tissulaire dans la bouche)., dysphagie (difficulté à avaler), gonflement du visage (gonflement) et constipation. Pour une liste complète des effets indésirables observés sous Foscan, voir la notice.
Foscan ne doit pas être utilisé chez les personnes pouvant présenter une hypersensibilité (allergie) à la témoporfine ou à l'un des composants du produit. Foscan ne doit pas être utilisé chez les patients atteints de porphyrie (incapacité à métaboliser les porphyrines), d'autres maladies exacerbées par la lumière, d'allergie aux porphyrines ou de tumeurs se propageant dans un vaisseau sanguin ou à proximité du site d'illumination. Foscan ne doit pas non plus être administré aux patients qui doivent subir une intervention chirurgicale pendant les 30 prochains jours, ni aux patients souffrant d'une maladie des yeux nécessitant une évaluation à la "lampe à fente" (un instrument utilisé par les ophtalmologistes pour examiner l'intérieur du produit). oeil pour les 30 prochains jours ou aux patients qui sont déjà traités avec un autre médicament qui augmente la sensibilité à la lumière.
Dans les six mois suivant l'injection de Foscan, les patients doivent éviter toute exposition à la lumière vive afin d'éviter le risque de brûlure de la peau. Pour plus de détails, voir la notice.
Pourquoi Foscan a-t-il été approuvé?
Le comité des médicaments à usage humain (CHMP) a conclu que les effets de Foscan sur l'atténuation des symptômes associés à un cancer de la tête et du cou avancé étaient remarquables. Par conséquent, le comité a décidé que les bénéfices de Foscan étaient supérieurs à ses risques en matière de traitement palliatif des patients atteints d'un carcinome épidermoïde avancé de la tête et du cou qui avaient échoué un traitement antérieur et ne pouvaient pas être traités par radiothérapie, chirurgie ou chimiothérapie systémique. Le comité a recommandé l'octroi d'une autorisation de mise sur le marché pour Foscan.
Foscan a été initialement autorisé dans des "circonstances exceptionnelles" car, du fait de la rareté de la maladie et pour des raisons scientifiques, les informations étaient rares au moment de l'autorisation. La société ayant fourni les informations complémentaires demandées, la restriction relative aux "circonstances exceptionnelles" a été supprimée le 21 mai 2008.
Informations complémentaires sur Foscan:
Le 24 octobre 2001, la Commission européenne a délivré une autorisation de mise sur le marché valable pour Foscan, valable dans toute l'Union européenne. Autorisation d'entrer
La transaction a été renouvelée le 24 octobre 2006. Le titulaire de l’autorisation de mise sur le marché est Biolitec Pharma Ltd.
Pour la version complète de l’EPAR Foscan, cliquez ici.
Dernière mise à jour de ce résumé: 05-2008