Par Dr. Rita Fabbri
Contre-indications, mises en garde spéciales et précautions particulières d'emploi, effets indésirables
Aloe vera gel peut être utilisé en toute sécurité dans des applications topiques: la gamme de ces produits disponibles sur le marché est vraiment vaste. En ce qui concerne le jus d’aloe vera, il n’existe actuellement aucune donnée précise sur la dose quotidienne optimale, mais il est recommandé de ne pas en prendre plus de 250 ml / jour (38).
Pour une utilisation topique, aucune contre-indication connue, aucun avertissement requis et aucun effet secondaire signalé. Bien que rares, des cas de réactions allergiques ont été rapportés.
Il a également été démontré que le gel d’aloe vera retarde la cicatrisation des plaies chirurgicales verticales profondes, telles que celles produites lors d’une césarienne (39).
Pour une utilisation systémique, voir l'annexe ci-dessous.
Notes pharmacologiques sur les anthraquinones
Les anthraquinones sont des substances qui stimulent le péristaltisme intestinal et ont donc un effet laxatif.
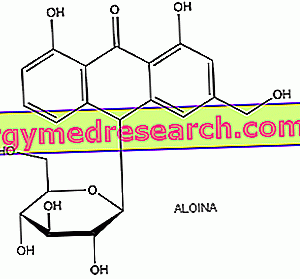
Les anthraquinones ont une structure chimique générale caractérisée par trois cycles benzéniques condensés et par des substituants qui occupent généralement les positions 9 et 10 car ils sont particulièrement réactifs. Les anthraquinones se trouvent normalement sous forme de glycosides, composés chimiques composés d’une partie de sucre (appelée glycine) et d’un non-sucre (appelé aglycone). Dans les glycosides d’anthraquinone, les aglycones appartiennent à la classe des dérivés d’anthracène; la barbaloine, par exemple, est un C-glycoside dérivé de l'aloe-hémodine antrone. La forme glycosidique permet à ces composés de transiter inchangés dans l'estomac et dans l'intestin grêle jusqu'au gros intestin, où ils sont transformés par la microflore bactérienne en leurs aglyons respectifs, leurs métabolites actifs réels, qui exercent localement une activité laxative de deux manières différentes. : accumulation de liquide dans la lumière intestinale et modification de la motilité intestinale; après quoi, sans être absorbés, ils se lient au contenu intestinal et sont expulsés avec les fèces.
L'absence ou une réduction de l'absorption des glycosides d'anthracène par le corps, ainsi que l'absence d'altération de la muqueuse intestinale, rendent ces produits sûrs et sans effets indésirables, à condition que certaines contre-indications soient observées et, ce qui est très important, ils sont utilisés aux doses recommandées et administrés uniquement lorsqu'ils sont réellement nécessaires.
Les laxatifs stimulants sont indiqués dans le traitement à court terme de la constipation occasionnelle. Dans la constipation chronique, toutefois, le changement des habitudes alimentaires, l'activité physique et la réadaptation intestinale constituent la meilleure solution (40-41).
L'utilisation de laxatifs pendant des périodes prolongées doit être évitée et il est conseillé de consulter le médecin s'ils sont pris plus de deux semaines.
Lorsque des épisodes de constipation se produisent de manière répétée, il est conseillé de rechercher les causes profondes du trouble.
La constipation n'est pas toujours associée à une atonie intestinale, elle peut parfois être provoquée par une hyperkinésie ou une dyskinésie, comme dans le cas du syndrome du côlon irritable. Très souvent, la constipation est exacerbée par des facteurs nerveux, l'anxiété ou le stress. Dans tous ces cas, les anthraquinones ne sont pas recommandées.
Tous les laxatifs stimulants sont contre-indiqués en cas de grossesse (42-44 ans) et d'allaitement (45 ans) - de petites quantités de métabolites passent dans le lait maternel - chez les enfants de moins de 10 ans, dans les maladies inflammatoires aiguës de l'intestin (colite ulcéreuse, entérocolite, appendicite, maladie de Crohn), en cas de douleur abdominale d'origine inconnue, d'obstruction intestinale et de sténose et de déshydratation grave avec manque de liquides et d'électrolytes (46).
Comme tous les laxatifs, les anthraquinones ne doivent pas être administrés en présence de symptômes abdominaux non diagnostiqués, aigus ou persistants.
Des doses élevées de laxatifs anthraquinoniques provoquent une vidange presque complète du côlon et l'absence naturelle de stimulation le lendemain (ou même les deux jours suivants) peut inciter les patients à réutiliser le laxatif, augmentant peut-être la posologie; Cela crée une dépendance psychologique dictée par l'angoisse du sujet à régulariser les délais entre une évacuation et la suivante.
L'abus de laxatifs anthraquinoniques peut entraîner des troubles de l'équilibre hydrique et électrolytique, notamment une hypokaliémie, un colon atonique et une aggravation de la constipation.
L'hypokaliémie améliore l'action des glycosides cardiaques et interagit avec les médicaments antiarythmiques. La combinaison avec d'autres médicaments induisant une hypokaliémie (tels que les diurétiques thiaziniques, les corticostéroïdes) peut aggraver le déséquilibre électrolytique (47). Le niveau d'électrolytes, en particulier de potassium, doit toujours être surveillé, en particulier chez les sujets âgés et les sujets jeunes.
La pigmentation sombre de la muqueuse colique, appelée pseudomélanose coli, observée après la prise chronique de laxatifs à l'anthraquinone (mais également d'autres laxatifs) n'est pas nocive et est réversible à l'arrêt du traitement.
De plus, la couleur de l'urine jaune brun ou rouge violet (dépendant du pH) en raison de l'effet des métabolites de l'anthraquinone n'est pas cliniquement significative (48-49).
Parfois, des spasmes et des douleurs abdominales peuvent survenir, en particulier chez les patients présentant un côlon irritable. Il s'agit d'une étude observationnelle très récente qui démontre comment une formulation spécifique du côlon contenant des anthraquinones de Senna angustifolia, mélangée à des huiles microencapsulées de Mentha piperita et de Matricaria camomilla, parvient à lutter contre la constipation sans toutefois provoquer des états inflammatoires évidents caractérisés par des douleurs, des spasmes, des distensions. abdominaux, météorisme, flatulence et états diarrhéiques (50).
bibliographie
- Kanter, MM, Radicaux libres et exercice: effets de la supplémentation en antioxydants nutritionnels. Exerc. Sport Sci. Rev., 23: 375.1995.
- Kanter, MM, et al., Effets d'un mélange de vitamines antioxydantes sur la peroxydation des lipides au repos et après l'exercice. 74: 965, 1993.
- Yamaguchi et al. (1993) Composants du gel d'Aloe vera. Bioscience Biotechnologie et biochimie. 57-8.1350-1352.
- Saben-Farideh (1993) Études sur l'état des enzymes antioxydantes et des métabolites en jachère, et sur la présence d'enzymes antioxydantes dans la plante Aloe vera (facteur de nécrose tumorale, glutathion), p 138.
- Davis, Didonato, Hartman (1994). Activité anti-inflammatoire et cicatrisante chez Aloe vera.
- PubMed Janvier 1989. Davis, Maro.
- Lushbaugh CC et Hale DB: radiodermite aiguë expérimentale à la suite d'un rayonnement bêta. V. Etude histopathologique du mode d’action du traitement par Aloe vera. Cancer 6, 690-698, 1953.
- Effets bénéfiques de l'aloès sur la guérison des plaies Heggers JP, Pelley RP, Robson MC Phytotherapy Research, vol 7, S48-S52 (1993). Département de chirurgie et École supérieure de sciences biomédicales, branche médicale de l'Université du Texas, Galveston, États-Unis.
- Davis RH, Leitner MG et Russian JM: Aloe vera, une approche naturelle pour traiter les plaies, les œdèmes et les douleurs associées au diabète. J Am Pod Med Assoc 78, 60-68, 1988.
- Ajabnoor MA: Effet de la glycémie chez des souris normales et diabétiques à l'alloxane. J. Ethnopharmacol 28, 215-220, 1990
- El Zawahry M, MR Hegazy et Helal M: Utilisation de l'aloès dans le traitement des ulcères de jambe et des dermatoses . Int J Dermatol 12, 68-73, 1973.
- Prise en charge du psoriasis avec l'extrait d'aloe vera dans une crème hydrophile: étude à double insu contrôlée par placebo Trop Med Int Health 1996, 1 août (1): 505-9 Syed TA; Ahmad SA; Holt AH; Ahmad SA, Ahmad SH; Afzal M Département de physiologie clinique, Hôpital universitaire de Malmo, Suède.
- Service de médecine de base. Institut de sécurité sociale. Rep. Saint-Marin. Janvier 2000 Andriani, Bugli, Alders, Castelli et al.
- Grindlay D et Reynolds T: Le phénomène de la feuille d’Aloe vera: examen des propriétés et de l’utilisation du gel de parenchyme foliaire. J Ethnopharmacol 16, 117-151, 1986.
- Shelton RW: Aloe Vera, ses propriétés chimiques et thérapeutiques . Int J J Dermatol 30, 679-683, 1991.
- Kahlon JB, et al.: Evaluation in vitro des effets antiviraux synergiques de l'acémannane en association avec l'azidothymidine et l'acyclorir. Mol Biother 3, 214-223, 1991.
- Anonyme: L'aloe vera pourrait stimuler l'AZT. Med Tribune, 22 août 1991, p.4.
- Pulse TL et Uhlig E: Amélioration significative d'une étude pilote clinique utilisant des suppléments nutritionnels, des acides gras essentiels et du jus d'aloe vera stabilisé chez 29 patients séropositifs, ARC et atteints du SIDA. J Adv Med 3, 209-230, 1990.
- Singer J: Essai randomisé, contrôlé contre placebo, d'acémannane oral en tant que traitement d'appoint au traitement antirétroviral dans le traitement de l'infection à VIH à un stade avancé. Int Conf AIDS 9 (1), 494, 1993. [Résumé n ° PO-B28-2153]
- Fiches MA et autres: Études de l'effet de l'acémannane sur les infections à rétrovirus: Stabilisation clinique de chats infectés par le virus de la leucémie féline. Mol Biother 3, 41-45, 1991.
- Hart LA, et al.: Effets des constituants de bas poids moléculaire du gel d'Aloe vera sur le métabolisme oxydatif et les activités cytotoxiques et bactéricides des neutrophiles humains . Int J Immunol Pharmacol 12, 427-434, 1990.
- Womble D et Helderman JH: Amélioration de la capacité de réaction des lymphocytes humains par l'acémannane (CarrisynTM). Int J Immunopharmacol 10, 967-974, 1988.
- Peng SY, et al.: Diminution de la mortalité du sarcome murin Norman chez des souris traitées avec l'immunomodulateur, acémannane. Mol Biother 3, 79-87, 1991.
- Harris C, et al.: Efficacité de l'acémannane dans le traitement des néoplasmes spontanés canins et félins. Mol Biother 3, 207-213, 1991.
- Laboratoires de recherche anti-tumoraux URSS. 1986. Gribel, Pashinskii.
- Fujita K, Ito S, Teradaira R, Beppu H, Propriétés de la carboxypeptidase de Aloe, Biochem. Pharmacol., 28: 1261-1262, 1979.
- Fujita K, Teradaira R, Nagatsu T: Activité de Bradykininase d'extrait d'aloès, Biochem. Pharmacol., 25: 205, 1976.
- Davis RH, et al.: Activité anti-inflammatoire d'Aloe vera contre un spectre d'irritants. J Am Pod Med Assoc 79, 263-266, 1989.
- Davis RH et ses collaborateurs: isolement d’un système inhibiteur actif à partir d’un extrait d’Aloe vera. J Am Pod Med Assoc 1991 mai; 81 (5): 258-61.
- Saito H, Purification des substances actives d'Aloe a. et leur activité biologique et pharmacologique, Phytother. Res., 7: S14-S1, 1993.
- Davis RH, et al.: Aloe vera, hydrocortisone et sterol influencent la résistance à la traction et l'anti-inflammation de la plaie. J Am Pod Med Assoc 1994 décembre; 84 (12): 614-21.
- Davis RH, et al.: Effet topique de l'aloès avec l'acide ribonucléique et la vitamine C sur l'arthrite adjuvante. J Am Pod Med Assoc 75, 229-237, 1985.
- Bland J: Effet du jus d'aloe vera consommé par voie orale sur la fonction gastro-intestinale de l'homme. Bulletin du réseau des aliments naturels, août 1985.
- Blitz JJ, Smith JW et Gerard JR: Gel d’aloe vera dans le traitement de l’ulcère peptique: rapport préliminaire. J Am Osteopathol Soc 62, 731-735, 1963.
- Yamaguchi I, Mega N, Sanada H: Composants du gel d’Aloe Vera Burm-f, Biosci. Biotech. Biochem., 57 (8): 1350-1352, 1993.
- Shida T et ses collaborateurs: Effet de l'extrait d'aloès sur la phagocytose périphérique de l'asthme bronchique chez l'adulte. Planta Medica 51, 273-275, 1985.
- Godding EW: Thérapeutique des laxatifs avec une référence particulière aux anthraquinones. Pharmacology 14 (Suppl 1), 78-101, 1976.
- Forces et limites de l'Aloe vera. Rowan Hamilton Journal américain de médecine naturelle, vol. 5, n ° 10; 30-33, décembre 1998.
- Schmidt JM et Greenspoon JS: Le gel pour plaies cutanées à l’aloe vera est associé à un retard de cicatrisation. Obstet Gynecol 78, 115-117, 1991.
- Steinegger E, Hansel R. Aloe. Dans: Pharmakognosie, 5ème éd. Berlin Springer, 1992: 428-31.
- Muller-Lissner S. Les effets indésirables des laxatifs: faits et fiction. Pharmacology 1993.47 (Suppl1): 138-45.
- Dérivés Westendorf J. Anthranoid - Espèces d'Aloe. Dans: De Smet PAGM, Keller K, Hansel R, Chandler RF, éditeurs. Effets indésirables des médicaments à base de plantes, volume 2. Berlin: Springer, 1993: 119-23.
- Bangel E, Pospisil M, Roetz R, Falk W. Tierexperimentelle pharmakologische untersuchungen zur Frage der abortiven und teratogenen Wirkung sowie zur Hyperamie von Aloe. Steiner-Informationsdienst 1975; 4: 1-25.
- Schmidt L. Vergleichende Pharmakologie und Toxikologie der Laxantien. Arch Exper Path Phamakol 1995; 226: 207-18.
- Faber P, Strenge-Hesse A. Revelance de l'excrétion de rhéine dans le lait maternel. Pharmacology 1988; 36 (Suppl 1): 212-20.
- Reynolds JEF, éditeur. Martindale - Le Extra Phama-copoeia. 31 e éd. Londres: Royal Pharmaceutical Society, 1996: 1202-3.1240-1.
- Brunton LL. Agents agissant sur le flux et la motilité de l’eau gastro-intestinale, les vomissements et les antiémétiques; acides biliaires et enzymes pancréatiques In: Hardman JG, Limbird LE, Molinoff PB, Ruddon RW, Gilman AG, éditeurs. Goodman & Gilman's The Pharmacological Basis of Therapeutics, 9e éd. New York: McGrew-Hill, 1996: 917-36.
- FJ allemand. Utilisation laxative dans la constipation. Am J Gastroenterol 1985; 80: 303-9.
- Ewe K, Karbach U. Diarrhée factice. Clin Gastroenterol 1986; 15: 723-40.
- Di Pierro F, Rapacioli G, Callegari A, Attolico M, Ivaldi L, Candidi C. Efficacité clinique dans la constipation d'une préparation à base d'anthraquinones et d'huiles essentielles: effet laxatif concomitant à action anti-inflammatoire. Le gastroentérologue ; Année XXXI, n.1-2 / 2009.