Dans la nature, le magnésium se trouve sous la forme de sels de magnésium, en raison de sa forte réactivité.
Si nous examinons la configuration électronique de cet élément chimique, nous remarquons la présence de deux électrons dans l’orbite la plus externe; de tels électrons sont facilement transférés à d'autres éléments chimiques qui ont besoin d'électrons pour compléter leur niveau d'énergie externe; le magnésium dépourvu de deux électrons est chargé positivement → ion magnésium Mg ++; si, au contraire, nous observons la configuration électronique du chlore, nous remarquons la présence de sept électrons dans l’orbite externe; Le chlore a donc tendance à attirer un électron électroniquement à lui-même, de manière à compléter l'octet; de cette manière, une fois acquis, l'électron manquant prend le nom d'ion chlore Cl-. Cela explique la formation de chlorure de magnésium (Mg Cl 2 ).
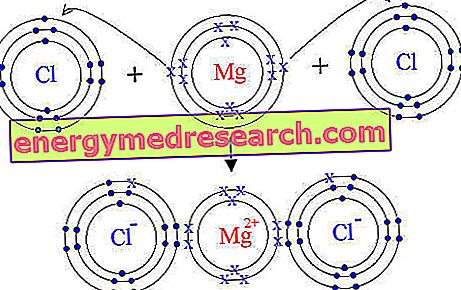
Après cette brève digression chimique, nous voyons brièvement les caractéristiques de santé des différents sels de magnésium.
La première caractéristique à considérer lors de l'évaluation d'un sel de magnésium du point de vue de la santé est la quantité de magnésium élémentaire qu'il contient; dans le cas rapporté ci-dessus, il est évident qu'un gramme de chlorure de magnésium contient un certain pourcentage de chlore élémentaire et une certaine quantité de magnésium élémentaire.
| Teneur en ions magnésium dans divers composés de magnésium (hydrates) | |
| Sel de magnésium | Grammes de magnésium par gramme du composé |
| Oxyde de magnésium | 0, 600 g |
| Citrate de magnésium | 0, 160 g |
| Chlorure de magnésium | 0, 120 g |
| Lactate de magnésium | 0, 120 g |
| Pyruvate de magnésium | 0, 100 g |
| Sulfate de magnésium | 0, 100 g |
| Pidolate de magnésium | 0, 087 g |
| Orotate de magnésium | 0, 077 g |
| Gluconate de magnésium | 0, 058 g |
Connaître la quantité de magnésium élémentaire présente dans les différents sels permet de connaître la quantité de sel à prendre pour couvrir les besoins quotidiens en ce minéral.
| Rapports de magnésium quotidiens appropriés | ||||
| âge (années) | hommes (Mg / jour) | Les femelles (Mg / jour) | grossesse (Mg / jour) | lactation (Mg / jour) |
| 1-3 | 80 | 80 | N / A | N / A |
| 4-8 | 130 | 130 | N / A | N / A |
| 13.9 | 240 | 240 | N / A | N / A |
| 14-18 | 410 | 360 | 400 | 360 |
| 19-30 | 400 | 310 | 350 | 310 |
| 31+ | 420 | 320 | 360 | 320 |
Étant donné que les sels de magnésium sont souvent pris pour augmenter les niveaux de ce minéral dans l'organisme et combler les carences, il semblerait logique de s'orienter vers l'ingestion de sels avec une teneur plus élevée en magnésium élémentaire. En réalité, cet aspect est subordonné à la capacité de l'intestin humain à absorber le magnésium contenu dans le sel (voir détails). Pour cette raison, afin de combler certaines carences en magnésium, il est important de choisir les meilleures sources absorbables, tandis que pour d'autres applications - telles que l'effet antiacide ou laxatif -, il est préférable d'utiliser des sels qui ne sont pas absorbés de manière importante par l'intestin humain.
En général, les sels de magnésium mieux absorbés sont ceux dans lesquels le minéral est lié à des composés organiques (gluconate, aspartate, pyruvate, malate, citrate, pidolate, lactate, orotate). Cependant, le chlorure de magnésium est toujours une source bien absorbable et, comparé aux précédents, présente l'avantage d'être peu coûteux. D'autre part, les autres sources de magnésium inorganique (oxyde de magnésium, carbonate de magnésium, sulfate de magnésium) sont les principales critiques de la biodisponibilité du magnésium qu'elles contiennent. Malheureusement, les études scientifiques publiées sur cette question sont encore insuffisantes pour établir avec certitude les applications sanitaires de différents sels de magnésium, étant donné la présence d'un petit nombre de recherches dont les résultats sont cependant souvent contradictoires. Pour cette raison, les éléments suivants - résultats de la relecture d'articles scientifiques et de textes universitaires - doivent être examinés avec la plus grande prudence.
| Sels de magnésium | Applications de santé |
| Citrate de magnésium | Il est considéré comme un sel de magnésium bien absorbable; par exemple, une étude a montré que son absorption était 4, 5 fois supérieure à celle d'un sel inorganique d'oxyde de magnésium; la présence de citrate pourrait être utile s'il est nécessaire d'augmenter le pH de l'urine, par exemple en cas de tendance à l'acide urique et / ou à la cystine |
| Pidolate de magnésium | Il est principalement connu pour une étude qui a démontré son efficacité possible dans le traitement du syndrome prémenstruel. La présence de l'acide piruglatammico semble donner à ce sel des effets neurosédatifs |
| Orotate de magnésium | Sel organique attribué à une meilleure tolérance gastro-intestinale et à une capacité d'absorption comparable à d'autres formes organiques; L'EFSA, l'autorité européenne chargée d'évaluer la sécurité des aliments, s'est dite préoccupée par le risque que l'acide orotique favorise la formation de tumeurs provoquée par divers agents cancérigènes connus. |
| Pyruvate de magnésium | --- |
| Taurinate de magnésium | --- |
| Magnésium malade | --- |
| Gluconate de magnésium | --- |
| Lactate de magnésium | Très soluble dans l'eau, il semble présenter une excellente capacité d'absorption |
| Chlorure de magnésium | Cette source de magnésium présente, parmi toutes les formes inorganiques, la meilleure solubilité dans l'eau. En conséquence, comme l'ont montré diverses études, sa biodisponibilité est similaire ou, dans tous les cas, légèrement inférieure à celle des sels organiques les plus nobles, avec l'avantage d'un coût inférieur. Sur le marché, pour des compléments minéraux spécifiques, le chlorure de magnésium se trouve également sous forme de comprimés enrobés pour améliorer sa tolérance à l'estomac. |
| Oxyde de magnésium | Bien qu’il s’agisse du sel le plus riche en magnésium élémentaire, c’est celui qui suscite les plus grandes critiques quant à la possibilité d’absorption par l’organisme. Peu soluble dans l'eau, de nombreuses études ont montré une biodisponibilité médiocre par rapport aux autres formes de magnésium. On suppose que les préparations fines, plus solubles dans l’eau, sont mieux absorbées que les préparations les plus grossières. |
| Hydroxyde de magnésium | Il est utilisé comme antiacide et laxatif: par exemple, il est l’un des deux principes actifs de Maalox. Compte tenu de sa faible solubilité dans l’eau, il est généralement attribué à une faible biodisponibilité, même si, dans une étude, il a été démontré qu’il augmentait les concentrations urinaires de magnésium dans une mesure comparable à celle de certains sels organiques, tels que le citrate de magnésium. |
| Carbonate de magnésium | Fortement insoluble dans l'eau et mal absorbé par le corps humain, il n'est généralement PAS utilisé comme source de magnésium dans les compléments alimentaires ou les aliments enrichis. Au lieu de cela, il trouve une application commune comme antiacide |
| Sulfate de magnésium | Il est utilisé dans les hôpitaux pour l'administration intramusculaire ou intraveineuse de magnésium. Il est également utilisé à des doses élevées (20 g) comme laxatif, souvent sous le nom de sel anglais ou de sel d’ Epsom . La biodisponibilité du magnésium contenu dans ce sel, pris par voie orale, est considérée comme faible. |



